|
||||
|
|
Глава XIIIМолекулярная биология: белок Ферменты и коферментыПроцесс обмена веществ, который стал особенно хорошо известен ученым в середине 50-х годов, можно считать своеобразным выражением ферментативной природы клетки. Любая метаболическая реакция катализируется благодаря специфическому ферменту; характер обмена веществ определяется природой и концентрацией присутствующих в клетке ферментов. Следовательно, чтобы понять обмен веществ, необходимо знать ферменты. Харден, открывший в начале нынешнего столетия промежуточный обмен веществ, обратил также внимание на еще одну сторону ферментативной деятельности. Он поместил в воду дрожжевой экстракт в небольшом мешке из диализирующей мембраны (через которую просачиваются только молекулы малых размеров). После того как через стенки мешка вышли мелкие молекулы экстракта, последний уже не мог расщеплять сахар. Объяснить это явление просачиванием через мембрану самого фермента нельзя, поскольку вода, в которой находился мешок, также не расщепляла сахара. Однако в соединении с экстрактом внутри мешка она приобретала эту способность. Следовательно, можно сделать вывод: помимо крупных молекул, фермент включает в себя и относительно мелкие, непрочно связанные и потому способные просачиваться через мембрану. Эти мелкие молекулы, являющиеся структурной частью фермента и очень важные для его функционирования, получили название коферментов. В середине 20-х годов шведский химик Ганс Карл Август Симон Эйлер (род. в 1873 г.) обнаружил, что и другие ферменты содержат коферменты, однако структуру последних удалось выяснить лишь десятилетием позже. Тогда же определили строение витаминов, после чего уже не вызывало сомнения, что в большинстве коферментов в качестве составной части молекулы имеются витаминоподобные структуры. Итак, витамины, по-видимому, являются той частью коферментов, которые не вырабатываются самим организмом и поэтому должны быть включены в пищу. Без витаминов построение коферментов невозможно, а без коферментов некоторые ферменты оказываются недеятельными и, таким образом, обмен веществ нарушается. В результате наступает авитаминоз, иногда со смертельным исходом. Поскольку ферменты и коферменты — это катализаторы, нужные организму в малых количествах, витамины тоже нужны в столь же небольших количествах. Этим, собственно, и объясняется тот факт, что ничтожнейшие составные части пищи могут оказаться крайне необходимыми для нормальной жизнедеятельности организма. Следовые количества таких элементов, как медь, кобальт, молибден, цинк, образуют существенную часть ферментной структуры. Были выделены ферменты, содержащие по одному или несколько атомов этих элементов. Что же следует сказать о самих ферментах? На протяжении прошлого столетия ферменты считались таинственными веществами, выявляемыми лишь по их действию. Немецкому химику Леонору Михаэлису (1875–1949) удалось раскрыть тайну ферментов с помощью законов и методов химической кинетики (раздела физической химии, изучающего скорость реакций). В 1913 г. он установил зависимость скорости реакций, катализируемых ферментами, от определенных условий. Он предположил, что фермент образует промежуточное соединение с веществом, реакцию которого он катализирует. Подобное допущение свидетельствует о том, что ферменты есть не что иное, как молекулы, подчиняющиеся физико-химическим законам. Но что же это за молекулы? По всей вероятности, это белки, так как ферментный раствор легко теряет активность даже при слабом нагревании, а, как известно, такую термолабильность имеют лишь белковые молекулы. Однако все это были лишь предположения. В 20-х годах немецкий химик Рихард Вильштеттер (1872–1942) выдвинул гипотезу, согласно которой ферменты вовсе не являются белками. Правда, как оказалось впоследствии, эта гипотеза была ошибочной, но научный авторитет ее автора долгое время не позволял в ней усомниться. Через несколько лет вопрос о белковой природе ферментов был поднят вновь, на сей раз американским биохимиком Джеймсом Бэчелором Самнером (1887–1955). В 1926 г. Самнер выделил из семян мечевидной канавалии фермент, катализирующий реакцию расщепления мочевины на аммиак и углекислый газ. В процессе получения фермента ученый обнаружил возникновение в определенный момент мельчайших кристаллов. Выделив и растворив эти кристаллы, он получил жидкость с повышенной активностью уреазы. Все попытки отделить эту активность от кристаллов не увенчались успехом. Полученные кристаллы оказались ферментами и, как показали опыты Самнера, одновременно и белками. Таким образом, уреаза была не только первым ферментом, полученным в кристаллическом виде, но и первым ферментом с доказанной белковой природой. Сомнениям относительно того, распространяется ли эта закономерность на все ферменты, положили конец исследования американского биохимика Джона Говарда Нортропа (род. в 1891 г.). В 1930 г. ученому удалось кристаллизовать пепсин — расщепляющий белок фермент желудочного сока; двумя годами позже — трипсин и в 1935 — химотрипсин. Трипсин и химотрипсин — расщепляющие белок ферменты поджелудочной железы. Они также оказались белками. После этого ученые получили в кристаллическом виде еще десятки ферментов, и все они были белками. К середине 30-х годов проблему ферментов уже нельзя было отделить от проблемы белков. Электрофорез и дифракция рентгеновских лучейРазвитие химических и физических методов в первой половине текущего столетия позволило биохимикам точнее исследовать крупные молекулы белка, которые, по представлениям ученых, являются основой жизни. Так создалась новая область науки — молекулярная биология, сочетающая в себе физику, химию и биологию. Основной задачей молекулярной биологии было детальное изучение тонкой структуры и функционирования гигантских молекул жизни. В 1923 г. шведский химик Теодор Сведберг (род. в 1884 г.) разработал новый метод определения размеров белковых молекул — центрифугирование. Сконструированная им ультрацентрифуга представляла собой вращающийся сосуд, который создавал центробежную силу, в сотни тысяч раз превышающую силу земного притяжения. Тепловое колебание молекул воды при обычной температуре достаточно для поддержания во взвешенном состоянии гигантских молекул белка. Оно противодействует силе земного притяжения, но не способно противостоять центробежной силе. Во вращающейся центрифуге молекулы белка осаждаются, или седиментируют. Молекулярный вес белковых молекул можно определить по скорости их оседания. Так, молекула средней величины, например молекула гемоглобина (пигмент крови), имеет молекулярный вес, равный 67 600. Эта величина в 3700 раз превышает молекулярный вес воды, равный 18. Другие белковые молекулы еще крупнее, их молекулярный вес выражается сотнями тысяч единиц. Размер и сложность белковой молекулы определяют размещение на ее поверхности атомов, способных нести электрические заряды. При этом каждому белку свойственно оригинальное расположение положительных и отрицательных зарядов, способное определенным образом изменяться в зависимости от изменения кислотности окружающей среды. Если раствор белка поместить в электрическое поле, отдельные белковые молекулы начинают двигаться либо к положительному, либо к отрицательному электроду со скоростью, обусловленной характером электрического заряда, размером и формой молекулы и т. д. Нет двух белков, которые в любых равных условиях обладали бы одинаковой скоростью. На основе этой закономерности шведский химик Арне Вильгельм Каурин Тизелиус (род. в 1902 г.), ученик Сведберга, в 1937 г. сконструировал прибор, который состоял из U-образной трубки с белковой смесью, способной перемещаться под действием электрического поля. (Это явление перемещения в электрическом поле взвешенных в жидкости частиц называется электрофорезом.) Ввиду того что каждый компонент смеси движется со свойственной ему скоростью, смесь можно постепенно разделить. U-образная трубка собирается из особым образом соединенных секций, ее легко расчленить. Благодаря этому каждую составную часть смеси, находящуюся в отдельной секции, можно отделить от остальных компонентов. Применяя соответствующие цилиндрические линзы и используя изменение отражения светового луча при прохождении его через суспендированную смесь (по мере изменения концентрации белков), стало возможным проследить процесс разделения смеси. Изменение рефракции давало на фотографии волнообразные кривые, по которым можно было вычислить количество каждого белка в смеси. В частности, белки плазмы крови, подвергнутые электрофорезу, были разделены на множество фракций, включая альбумин и три группы глобулинов — α, β и γ, — причем фракция γ-глобулинов содержала антитела. В 40-е годы были разработаны методы промышленного получения различных белковых фракций. Ультрацентрифугирование и электрофорез зависели от общих свойств молекулы белка. Применение рентгеновских лучей позволило биохимикам исследовать внутреннее строение молекулы. Проходя через вещество, пучок рентгеновских лучей рассеивается. Если частицы вещества расположены в строгом порядке (как атомы в кристалле), то рассеяние лучей будет также упорядочено. Пучок рентгеновских лучей, попадая на фотопленку после рассеяния кристаллом, даст симметричное расположение точек. На основании такого рисунка можно определить положение атомов в кристалле. Крупные молекулы нередко состоят из более мелких единиц, равномерно расположенных внутри молекулы. Это справедливо и для белковых молекул, структурными единицами которых являются аминокислоты. О расположении аминокислот в молекуле белка можно судить по тому, как рассеивается пучок рентгеновских лучей. Хотя рассеяние луча белками выражено не столь ярко, как рассеяние кристаллами, его все же можно использовать для анализа белков. Общая картина пространственного расположения аминокислотных единиц была выявлена в начале 30-х годов. Выдающиеся исследования американского химика Лайнуса Полинга (род. в 1901 г.) выявили точное распределение аминокислот и показали, что их цепь представляет собой улиткообразную спираль. По мере того как ученые все глубже проникали в строение белка, они получали все более сложные результаты рентгеноструктурного анализа. Появилась необходимость в сложных и трудоемких математических вычислениях, которые были не под силу человеческому разуму. К счастью, в 50-х годах была создана электронно-вычислительная машина, способная в кратчайший срок выполнять длиннейшие ряды вычислений. Впервые электронно-вычислительную машину применили для изучения витаминов. Еще в 1926 г. два американских врача, Джордж Ричард Майнот (1885–1950) и Уильям Перри Мерфи (род. в 1892 г.), заметили, что регулярное введение печени в диету больных так называемым злокачественным малокровием спасает их от, казалось бы, неминуемой смерти. Они предположили, что это свойство печени обусловлено присутствием витамина. Этот витамин, получивший название В12, удалось выделить только в 1948 г. Его молекула оказалась очень сложной; она состоит из 183 атомов шести различных элементов. В 1956 г., используя новые физические методы и вычислительную аппаратуру, группа ученых под руководством шотландского химика-органика Александра Тодда (род. в 1907 г.) выяснила детальное строение этого витамина. Поскольку среди прочих структур он содержал циангруппу, атом кобальта и аминогруппу, витамин получил название цианокобаламина. Неизбежность применения электронно-вычислительных машин при дифракционном изучении белков стала очевидной. В 1960 г., используя метод дифракции рентгеновских лучей и вычислительные машины, английские биохимики Макс Фердинанд Перутц (род. в 1914 г.) и Джон Каудери Кэндрю (род. в 1917 г.) смогли дать полную картину строения молекулы миоглобина (мышечного белка, в какой-то степени напоминающего гемоглобин, но в четыре раза более мелкого) с точным указанием расположения каждой аминокислоты. Метод хроматографииВыяснить строение крупных молекул посредством метода дифракции рентгеновских лучей значительно легче, если известны химическая природа субъединиц молекул и хотя бы в общем виде их расположение. Прогресс в изучении химии белка был достигнут не сразу. Ученые минувшего столетия могли только весьма голословно утверждать, что белковая молекула состоит из аминокислот. На рубеже XX в. немецкому химику Эмилю Герману Фишеру (1852–1919) удалось показать, каким образом аминокислоты комбинируются в молекуле белка. В 1907 г. он даже получил очень простое белковоподобное соединение, состоящее из 18 единиц: 15 молекул одной аминокислоты и 3 молекулы другой. Какова же структура более сложной белковой молекулы, встречающейся в природе? И в первую очередь, каково точное число каждого типа аминокислот в молекуле белка? Проще всего ответить на этот вопрос, расщепив белковую молекулу на отдельные аминокислоты и на основании химического анализа определив относительное количество каждого компонента. Однако для современников Фишера этот путь был неприемлем. В те времена обычными химическими методами нельзя было различить аминокислоты, обладавшие сходным строением. Ответ на этот вопрос пришел с появлением нового метода, принцип которого в 1903 г. впервые разработал русский ботаник Михаил Семенович Цвет (1872–1919). Исследуя пигменты растений, Цвет получил сложную смесь, состоящую из столь сходных компонентов, что разделить ее существовавшими химическими методами было почти невозможно. Тогда ученый пропустил раствор смеси по каплям через стеклянную трубку (колонку), заполненную порошком окиси алюминия. Поверхность частиц порошка с разной силой удерживала различные вещества смеси. Когда смесь смывали свежим растворителем, вещества разделялись. Компоненты, наименее прочно связанные с поверхностью порошка, смывались в первую очередь. В конце концов смесь оказывалась разделенной на отдельные пигменты, каждый из которых характеризовался определенной полосой цвета в спектре. Этот метод разделения по цвету получил название хроматографии (от греческих слов chrömatos — окраска, цвет и graphein — записывать). К сожалению, работы Цвета прошли незамеченными. Только через полтора десятилетия Вильштеттер, вновь применив метод Цвета, добился его признания. Хроматографию стали широко применять для разделения сложных смесей. Однако пользоваться колонкой из порошка окиси алюминия для разделения ничтожных количеств смеси было чрезвычайно сложно. Требовался более простой и надежный метод. Выход был найден лишь в 1944 г., когда английские биохимики Арчер Джон Портер Мартин (род. в 1910 г.) и Ричард Лоуренс Миллингтон Синдж (род. в 1914 г.) использовали для метода хроматографии простую фильтровальную бумагу. Опыты проводили так. Каплю смеси аминокислот просушивали близ нижнего края полоски фильтровальной бумаги, а затем опускали его в специальный растворитель. Последний, по закону капиллярности, поднимался по полоске вверх. Проходя через высушенную каплю, растворитель увлекал за собой отдельные аминокислоты со скоростью, характерной для каждой конкретной аминокислоты. В итоге смесь аминокислот оказывалась разделенной. Расположение аминокислот на бумаге выявлялось посредством специальных физических и химических методов. Определить количество аминокислоты в каждом пятне не составляло труда. Новый метод хроматографии на бумаге оказался на редкость эффективным. Он прост и дешев, не требует сложной аппаратуры, позволяет тщательно разделять ничтожные количества компонентов смеси. Метод получил широкое применение во всех областях биохимии. Им, в частности, воспользовался Кэлвин в своих экспериментах со смесью фотосинтезирующих растительных клеток. По существу, исследования без применения метода хроматографии на бумаге стали немыслимы. С его помощью появилась возможность установить точное количество различных аминокислот того или иного белка. Это в свою очередь позволило определить аминокислотный состав одного белка за другим, подобно тому как устанавливают число атомов различных элементов, входящих в то или иное соединение. Расположение аминокислотНо всего этого оказалось недостаточно. Как известно, химиков интересует не только число атомов в любом соединении, но и их расположение. То же относится и к аминокислотам в молекуле белка. Вопрос о расположении аминокислот сложен. Даже если в молекуле всего несколько десятков аминокислот, число возможных сочетаний астрономически велико, а если их больше 500 (как, например, в гемоглобине, где молекула средней величины), число возможных расположений выражается цифрой из 600 знаков. Как же из такого невообразимого числа возможностей правильно выбрать наиболее вероятное расположение аминокислот каждого конкретного белка? Оказалось, что с помощью метода хроматографии на бумаге эта проблема разрешается очень легко. Однако английскому биохимику Фредерику Сэнгеру (род. в 1918 г.) понадобилось восемь лет, чтобы исследовать этим методом молекулу инсулина, состоящую всего из 50 аминокислот! Сэнгер расщеплял молекулу на части, методом хроматографии на бумаге разделял короткие цепи и определял слагающие их аминокислоты, а также порядок расположения последних. Это было нелегкой задачей, ибо даже четырехкомпонентный фрагмент может располагаться 24 различными способами. Выявив, каким более коротким цепям дают начало длинные цепи, Сэнгер мало-помалу воссоздал структуру более длинных цепей. К 1953 г. он уже знал точный порядок аминокислот в молекуле инсулина. 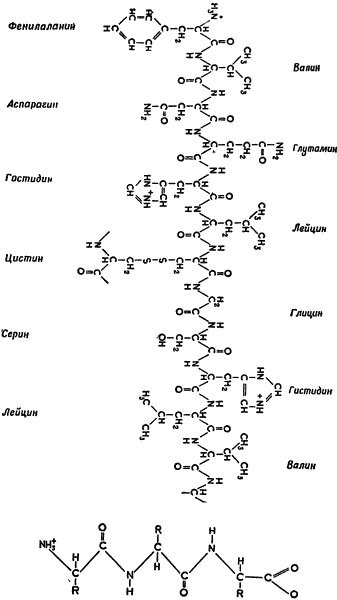 Рис. 6. Химическая формула, показывающая сложную структуру белка. Выше изображена часть одной из двух пептидных цепей, которые образуют молекулу инсулина. Полипептидный скелет повторяется по центру цепи, образованной связанными аминокислотами и их различными боковыми цепями. Ниже изображен пептид, содержащий три аминокислоты, R — боковые аминокислотные цепи. Вслед за Сэнгером его методом воспользовался американский биохимик Винсент Виньо (род. в 1901 г.). Он применил его к очень простой молекуле окситоцина (гормона задней доли гипофиза), состоящей всего из восьми аминокислот. Установив расположение аминокислот, Виньо попытался синтезировать соединение таким образом, чтобы каждая аминокислота находилась на полагающемся ей месте. Синтез был осуществлен в 1955–1956 гг.; полученный в результате синтетический окситоцин по своим свойствам не уступал природному гормону. Аналитический метод Сэнгера, равно как и синтез Виньо, впоследствии был повторен в более широком масштабе. В 1960 г. ученые установили расположение аминокислот в ферменте, названном рибонуклеазой. Молекула рибонуклеазы состоит из 124 аминокислот, это в два с половиной раза превышает число аминокислот в молекуле инсулина. Фрагменты рибонуклеазы синтезировали, после чего изучали их ферментативную активность. Таким образом, к 1963 г. удалось установить, что для функционирования молекулы существенно необходимы аминокислоты 12 и 13 (гистидин и метионин). Это было значительным шагом вперед в определении точного механизма функционирования молекулы фермента. К середине текущего столетия белковая молекула оказалась «прирученной». |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Наверх |
||||
|
|
||||
